Email terdiri dari senyawa hidroksiapatit, . Senyawa ini sedikit larut dalam suasana asam karena mengalami reaksi sebagai berikut:
\text{
Suasana asam dapat terjadi karena pengaruh bakteri dalam mulut ketika menguraikan sisa-sisa makanan yang terselip di gigi. Hal ini akan menyebabkan terja demineralisasi email, dan email akan rusak. Kerusakan ini dapat dicegah dengan menyikat gigi secara teratur, terutama sehabis makan. Salah satu cara lain adalah menambahkan senyawa fluorida ke dalam pasta gigi. Menyikat gigi dengan pasta gigi yang mengandung fluorida dapat mengubah senyawa hidroksiapatit menjadi fluoroapatit.
\text{
Senyawa fluoroapatit lebih sukar larut dalam suasana asam.
sumber : www.olimpiade.org
Senin, 21 Desember 2009
Mengapa Senyawa Fluorida Ditambahkan ke dalam Pasta Gigi
Diposting oleh lnurlaily di 21.48 0 komentar
Manfaat baru botol plastik bekas

Vilas Pol dari Bar-Ilan University, Ramat-Gan, Israel, dan rekan-rekannya menghasilkan mikrosfer karbon yang kuat dari PET (polietilen tereftalat) sampah. Mereka memanaskannya botol cola bekas pakai pada suhu 700oC selama tiga jam dalam sebuah reaktor tertutup. Plastik kemudian didekomposisi dibawah tekanan yang terbentuk sendiri untuk menghasilkan bola karbon yang keras dengan diameter antara dua sampai 10 mikrometer. “Salah satu pisau mata berlian kami patah dan yang lainnya rusak pada saat kami mencoba memotong melintang bola karbon ini,” kata Pol.
“Kekuatan material-material ini sangat menarik,” kata Neil Coville, koordinator grup Carbon Nanotubes and Strong Composites di University of the Witwatersrand, Johannesburg, Afrika Selatan. “Hasil ini sangat mengesankan dan kita harus mempertimbangkan penggunaan material ini di masa mendatang”.
“Proses ini sangat menarik,” kata Philippe Serp, seorang ahli di bidang nano-struktur karbon di National Center for Scientific Research, Toulouse, Perancis, “Karena proses ini tidak memerlukan katalis.” Proses yang bisa ditingkatkan menjadi skala industri ini juga tidak memerlukan pelarut dan lebih baik dari metode-metode sekarang yang memiliki kekurangan seperti hasil yang rendah dan pemisahan bola-bola karbon yang tidak maksimal jelaga karbon.
Bola-bola karbon digunakan dalam penyimpanan energi dan piranti-nano. Mikrosfer yang dibuat Pol ini bisa tahan pada tekanan yang sangat tinggi, sehingga dapat digunakan dalam pelumas. Mengurangi suhu reaksi dibawah 700oC akan memberikan partikel-partikel karbon yang lebih besar yang bisa digunakan dalam piranti seperti printer, toner, dan teknologi filtrasi.
“Tantangan yang dihadapi komunitas sains sekarang ini untuk mencari solusi yang inovatif untuk degradasi polimer-polimer limbah telah memotivasi kami,” papar rekan Pol, Aharon Gedanken. “Proses yang kami gunakan ini menunjukkan sebuah cara untuk merubah limbah polimer PET menjadi produk-produk yang bernilai industri.
sumber: http://rsc.org/chemistryworld
Diposting oleh lnurlaily di 21.27 0 komentar
Lilin Wangi yang Berbahaya Bagi Kesehatan
 Menurut American Lung Association (ALA) nyala lilin terutama yang beraroma wewangian dan nyalanya tahan lama akan menghamburkan partikel timah, merkuri dan racun lainnya ke udara. Selanjutnya ALA mengingatkan bahwa lilin-lilin yang beraroma eksotis biasanya mempunyai sumbu berkilapan yang terbuat dari timah murni atau campuran yang mengandung timah. Partikel timah yang sangat kecil akan melayang diudara dalam kurun waktu yang lama hingga kemudian akhirnya menempel pada furniture dan karpet yang terpapar untuk disentuh oleh anak-anak, orang dewasa , ataupun binatang peliharaan.
Menurut American Lung Association (ALA) nyala lilin terutama yang beraroma wewangian dan nyalanya tahan lama akan menghamburkan partikel timah, merkuri dan racun lainnya ke udara. Selanjutnya ALA mengingatkan bahwa lilin-lilin yang beraroma eksotis biasanya mempunyai sumbu berkilapan yang terbuat dari timah murni atau campuran yang mengandung timah. Partikel timah yang sangat kecil akan melayang diudara dalam kurun waktu yang lama hingga kemudian akhirnya menempel pada furniture dan karpet yang terpapar untuk disentuh oleh anak-anak, orang dewasa , ataupun binatang peliharaan.
Jika terserap kedalam tubuh dalam jumlah yang melebihi ambang batas emisi lilin-lilin tersebut dapat merusak sistem syaraf, hati dan sistem peredaran darah, terutama pada anak-anak, orang tua, dan pada orang-orang dengan sistem kekebalan yang lemah. Dampak lainnya lilin-lilin tersebut dapat menghasilkan jelaga berjumlah banyak yang akan merusak furniture dan penghawaan ventilasi.
Dianne Walsh Astry Direktur Eksekutif pada Health House Project, suatu badan pemasyarakatan program pendidikan ALA mengatakan bahwa tanpa disadari, lilin-lilin merupakan penyebab buruknya kualitas udara dalam ruangan. Para pengguna atau konsumen sebaiknya membaca label yang tertera pada produk lilin tersebut agar dapat terhindar dari bahaya yang disebabkan adanya zat tambahan pada lilin yang dapat membahayakan. Sebaiknya pula hindarkan penempatan lilin pada daerah yang banyak angin, dimana angin dapat lebih menebarkan jelaga dan racun ke udara.
sumber : http://www.chem-is-try.org/artikel_kimia/kimia_lingkungan/lilin-wangi-yang-berbahaya-bagi-kesehatan/
Diposting oleh lnurlaily di 21.24 0 komentar
elektronik bertenaga gula
 Ilmuwan di Jepang telah membuat sebuah sel bahan-bakar hayati (biofuel cell) yang menghasilkan energi yang cukup untuk menjalankan sebuah mp3 player atau mobil remot mainan. Ilmuwan di Jepang telah membuat sebuah sel bahan-bakar hayati (biofuel cell) yang menghasilkan energi yang cukup untuk menjalankan sebuah mp3 player atau mobil remot mainan.Dengan terinspirasi oleh proses pembangkitan energi pada makhluk-makhluk hidup, Tsuyonobu Hatazawa, dari Sony Corporation, Kanagawa, dan rekan-rekannya membuat sebuah bio-baterai yang menghasilkan listrik dari glukosa dengan menggunakan enzim sebagai katalis. Sel biofule yang sederhana terdiri dari sebuah anoda dan sebuah katoda yang dipisahkan oleh sebuah membran penghantar foton. Sebuah bahan bakar terbaharukan, seperti gula, dioksidasi oleh mikroorganisme-mikroorganisme pada anoda, menghasilkan elektron dan proton. Proton berpindah melalui membran ke katoda sedangkan elektron ditransfer ke katoda melalui sebuah sirkuit eksternal. Elektron dan proton bergabung dengan oksigen pada katoda membentuk air. Sampai sekarang, output energi dari sel-sel biofuel masih terlalu rendah untuk pengaplikasian praktis. Transfer elektron pada sebuah sel biofuel bisa berlangsung lambat sehingga Hatazawa menggunakan sebuah turunan naftoquinon − yang dikenal sebagai mediator transfer elektron − untuk mengacak elektron-elektron antara elektroda dan enzim. Ini meningkatkan kepadatan arus − sebuah ukuran laju dari reaksi elektrokimia − dan meningkatkan luaran daya. Untuk lebih meningkatkan kepadatan arus, Hatazawa memadukan mediator tersebut dan enzim ke dalam sebuah anoda serat-karbon. Daerah permukaan yang luas dan porositas elektroda menghindari terjadinya gangguan transport glukosa dan mempertahankan aktivitas enzim. Mereka menggunakan rancangan yang serupa untuk mengoptimalkan katoda sehingga menyuplai oksigen yang cukup ke sel bahan bakar. Pada saat mereka menumpuk empat sel ini bersama-sama, mereka mencapai luaran daya sebesar 100 miliwatt − cukup untuk menjalankan sebuah mp3 player dengan speaker atau mobil remot yang kecil.  Empat unit sel biofuel dalam rangkaian bisa menyalakan sebuah mp3 player lengkap dengan speaker Adam Heller, seorang ahli di bidang bioelektrokimia dari Universitas Texas di Austin, Amerika Serikat, mengatakan penelitian ini "akan menjadi cikal bakal lahirnya sel-sel biofuel yang bermanfaat, setelah bertahun-tahun dilakukan penelitian yang tak kunjung membuahkan hasil". sumber : http://www.rsc.org/chemistryworld/ http://www.chem-is-try.org/?sect=artikel&ext=210 http://chemistry.uii.ac.id/index.php?option=com |
Diposting oleh lnurlaily di 20.57 0 komentar
Dibalik Lezatnya Es Krim
 Es-krim Seperti juga coklat, merupakan makanan favorit tua muda. Apa istimewanya es krim sehingga disuka banyak orang? Tentu saja karena rasanya yang enak dan teksturnya yang sangat lembut tidak seperti es pada umumnya.
Es-krim Seperti juga coklat, merupakan makanan favorit tua muda. Apa istimewanya es krim sehingga disuka banyak orang? Tentu saja karena rasanya yang enak dan teksturnya yang sangat lembut tidak seperti es pada umumnya.Ingin tahu mengapa es krim beda dengan es batu biasa???
Es krim adalah buih setengah beku yang mengandung lemak teremulsi dan udara. Sel-sel udara yang ada berperanan untuk memberikan texture lembut pada es krim tersebut. Tanpa adanya udara, emulsi beku tersebut akan menjadi terlalu dingin dan terlalu berlemak.
Bahan utama dari es krim adalah lemak (susu), gula, padatan non-lemak dari susu (termasuk laktosa) dan air. Sebagai tambahan, pada produk komersil diberi emulsifier, stabiliser, pewarna, dan perasa. Sebagai emulsifier biasanya digunakan lesitin, gliserol monostearat atau yang lainnya. Emulsifier ini berguna untuk membangun distribusi struktur lemak dan udara yang menentukan dalam membentuk sifat rasa/tekstur halus dan pelelehan yang baik. Untuk stabilisernya bisa digunakan polisakarida dan ini berfungsi sebagai penambah viskositas. Sedangkan pewarna dan perasa bisanya bervariasi tergantung pada selera pasar. Jika ingin diberi rasa strawberry tentunya diberi perasa strawberry dan pewarna merah. Ingat, pewarna yang diberikan tentunya harus pewarna makanan bukan pewarna tekstil lho.
Bahan-bahan tersebut dicampur, dipasteurisasikan, dihomogenasikan, dan didinginkan dengan cepat. Setelah emulsi minyak dalam air tersebut dibiarkan dalam waktu yang lama, kemudian dilewatkan dalam kamar yang suhunya cukup rendah untuk membekukan sebagian campuran. Pada saat yang sama udara dimasukkan dengan cara dikocok. Tujuan dari pembekuan dan aerasi ini adalah pembentukan buih yang stabil melalui destabilisasi parsial dari emulsi. Pengocokan tanpa pendinginan tidak akan memberikan buih yang stabil. Jika buih terlalu sedikit produknya akan tampak basah, keras dan sangat dingin. Sedang jika buihnya terlalu banyak maka produknya akan tampak kering. Sel-sel udara pada es krim harus berukuran sekitar 100 mikron. Jika sel udaranya terlalu besar, es krimnya akan meleleh dengan cepat. Sedang jika sel udaranya terlalu kecil maka buihnya akan terlalu stabil dan akan meninggalkan suatu ‘head’ ketika meleleh.
Es krim mempunyai struktur koloid yang kompleks karena merupakan buih dan juga emulsi. Buih padat terjadi karena adanya lemak teremulsi dan juga karena adanya kerangka dari kristal-kristal es yang kecil dan terdispersi didalam larutan makromolekular berair yang telah diberi gula. Peranan emulsifier (misalnya: gliserol monostearat komersial) adalah untuk membantu stabilisasi terkontrol dari emulsi didalam freezer. Perubahan-perubahan polimorfis lemak pada es krim selama penyimpanan menyebabkan perubahan bentuk pada globula awalnya, yang berkombinasi dengan film protein yang agak lepas, menyebabkan terjadinya penggumpalan di dalam freezer. Stabilisasi gelembung-gelembung udara pada es krim juga terjadi karena adanya kristal-kristal es dan fasa cair yang sangat kental. Stabiliser polisakarida (misalnya: carrageenan) menaikkan kekentalan fasa cair, seperti juga gula pada padatan non-lemak dari susu. Stabiliser-stabiliser ini juga dikatakan dapat memperlambatan pertumbuhan kristal-kristal es selama penyimpanan. Hal ini karena jika kristal-kristal esnya terlalu besar maka akan terasa keras di mulut.
Nah ternyata es krim itu seru kan, gak cuma berisi air saja. Hayooo…. Siapa yang jadi ingin makan es krim???
sumber : www.chemistry.uii.ac.id
Diposting oleh lnurlaily di 20.47 0 komentar
Kejutan fluoresensi dari buah pisang
Mungkinkah pisang-pisang masak akan menjadi glowstick yang baru untuk klub-klub malam? Buah yang berwarna kuning ini bersinar biru terang dibawah sinar UV, sebuah temuan yang mengejutkan pada peneliti di Austria. Intensitas pancaran sinar biru mencapai puncak pada saat buah ini dalam kematangan sempurna untuk dimakan.
Fluoresensi ini, yang tidak ditemukan pada tanaman atau buah lain manapun, tampaknya berasal dari produk-produk penguraian dari klorofil − yang mana dalam buah pisang memerlukan waktu lebih lama dari biasanya untuk dikonversi menjadi senyawa-senyawa yang tidak berwarna. Mereka kemudian menyelidiki kulit-kulit pisang yang masak alami dan masak buatan dibawah sinar ultraviolet dan menemukan pancara sinar biru terang. "Yang paling mengherankan kami adalah bahwa belum ada seorang pun yang melaporkan hal ini sebelumnya," tambah Kräutler.

Pisang masak menyala biru dibawah sinar UV

Peranan di alam
Seperti halnya peranan yang dimiliki zat kimia ini dalam lingkungan, kemungkinan banyak peran-peran lain yang dimiliki. Kräutler berspekulasi bahwa dibawah sinar matahari langsung, fluoresensi biru kemungkinan berkontribusi bagi warna kuning terang yang khas dari pisang, dan memungkinkan untuk ditemukan lebih mudah oleh makhluk-makhluk yang memakannya. Philip Rea di Universitas Pennsylvania, US, juga terkejut dengan temuan ini, tetapi kurang yakin dengan peranan tersebut yang dimiliki oleh senyawa ini di alam. "Banyak hewan pemakan buah yang memakan pisang, misalnya kelelawar buah, yang beroperasi di malam hari." Yang lainnya bergantung pada penciuman, atau memerlukan jarak pandang yang sangat sempit untuk menemukan emisi biru tersebut.
Dugaan lain adalah bahwa senyawa-senyawa fluoresens biru ini bisa memegang peranan biologis, misalnya mengkatalisis reaksi-reaksi tertentu atau mungkin hanya melindungi pisang dari sinar UV yang memungkinkan buah tetap segar dalam jangka waktu yang lebih lama. Tim Kräutler masih terus meneliti dan sekarang ini beralih ke buah-buah lain yang memiliki perilaku serupa dengan pisang.
sumber : http://www.rsc.org/chemistryworld/
Diposting oleh lnurlaily di 20.46 0 komentar
Resiko Toksik pada Air Botol?
 Peneliti geokimia di Jerman mengklaim bahwa botol-botol plastik secara terus menerus melepaskan unsur antimonium (Sb) ke dalam air minum. Peneliti geokimia di Jerman mengklaim bahwa botol-botol plastik secara terus menerus melepaskan unsur antimonium (Sb) ke dalam air minum.Tim peneliti yang dipimpin oleh Bill Shotyk di University of Heidelberg menguji air-air yang dikemas dalam botol di daerah yang sama di Canada. Air yang dikemas dalam botol polietilen tereftalat (PET) mengandung hingga 375 ppt antimonium, sedangkan air dalam botol polipropilen mengandung hanya 8,2 ppt antimonium. Tiga bulan kemudian, air dalam botol PET mengandung hingga 626 ppt antimonium. PET dibuat dengan menggunakan katalis antimonium. Kelompok peneliti Shotyk menguji air tanah yang berasal dari daerah yang sama di Canada, dengan menggunakan alat penganalisis biji es yang sangat sensitif. Kadar antimonium yang mereka temukan sangat rendah (2 ppt). Laporan-laporan terdahulu melaporkan kandungan rata-rata 300 ppt. "Saya tidak yakin berapa banyak lab di luar sana yang benar-benar bisa mengukur berapa banyak antimonium yang terdapat dalam air tanah, kebanyakan orang memiliki batas deteksi yang jauh di atas nilai alami pada air tanah," kata Shotyk. Kadar antimonium dalam air botol yang diteliti ini lebih rendah dari kadar pengkontaminasi maksimum yang dianjurkan oleh EPA Amerika Serikat, yakni 6 bagian per juta. Shotyk lebih khawatir bahwa antimonium terus menerus terlepas ke dalam air dalam kemasan botol. "Yang ingin saya tunjukkan bukan bahwa air-air botol ini terkontaminasi oleh antimonium," kata dia, "tetapi hal yang penting adalah bahwa antimonium secara terus menerus dilepaskan dari botol ke dalam air". David Coggan, seorang ahli epidemiologi dari unit epidemiologi lingkungan MRC di Southampton, Inggris, menunjukkan sikap yang berhati-hati dalam menanggapi temuan ini. Hasil yang ditunjukkan oleh Shotyk masih memerlukan penyelidikan lebih lanjut sebelum implikasi kesehatannya bisa dibahas, kata dia, sebagian karena masih sedikit yang diketahui tentang toksisitas antimonium. "Penting untuk memikirkan tentang rentang dosis berapa yang akan didapatkan oleh orang yang meminum air tersebut," kata Coggan. Meski demikian, Shotyk yang menemukan temuan ini tidak lagi meminum air yang dikemas dalam botol-botol PET. sumber :http://www.rsc.org/chemistryworld/ |
Diposting oleh lnurlaily di 20.33 0 komentar
Air, si Cantik Yang Tersia-sia
 Baru-baru ini Indonesia mengalami rentetan bencana yang berkaitan dengan air, mulai dari banjir hingga yang terakhir adalah kekeringan. Sebenarnya istilah bencana kekeringan tidak tepat juga karena kenyataannya negara kepulauan kita dikelilingi oleh air, namun tepat adanya jika kita menyebut krisis air bersih. tentu saja terjadi krisis air terutama di pulau Jawa yang berpenduduk padat dan memiliki lokasi industri demikian banyak oleh karena masih sedikit kepedulian kita terhadap zat yang cantik dan vital tersebut. Bahkan lahan tempat sumber-sumber airpun dijarah atas nama pembangunan sehingga pembangunan berwawasan lingkungan hanya tinggal menjadi istilah yang hebat namun hampa.
Baru-baru ini Indonesia mengalami rentetan bencana yang berkaitan dengan air, mulai dari banjir hingga yang terakhir adalah kekeringan. Sebenarnya istilah bencana kekeringan tidak tepat juga karena kenyataannya negara kepulauan kita dikelilingi oleh air, namun tepat adanya jika kita menyebut krisis air bersih. tentu saja terjadi krisis air terutama di pulau Jawa yang berpenduduk padat dan memiliki lokasi industri demikian banyak oleh karena masih sedikit kepedulian kita terhadap zat yang cantik dan vital tersebut. Bahkan lahan tempat sumber-sumber airpun dijarah atas nama pembangunan sehingga pembangunan berwawasan lingkungan hanya tinggal menjadi istilah yang hebat namun hampa.Melihat air yang jernih bagaikan melihat permata berlian yang berkilauan. Sesungguhnya air yang cair itu adalah kumpulan trilyunan molekul H2O. Dalam dunia kimia dikenal H sebagai atom hidrogen dan O sebagai atom oksigen. Jadi H2O adalah satu molekul air yang mengandung satu atom oksigen dan 2 atom hidrogen. Padahal kita tahu bahwa pada tekanan atmosfer, oksigen dan hidrogen berwujud gas tapi ketika mereka bersatu saling mengikat janji bisa berubah wujudnya menjadi cair. Berkat kecerdasan kimiawan masa lalu kita dapat melakukan perhitungan begini, dalam 18 gram atau kurang lebih 18 mililiter air terkandung 6,022 x 1023 molekul H2O. Jadi, jika satu milyar adalah 10 maka bilangan tadi bermakna 602,2 ribu milyar milyar dan bilangan tersebut dikenal sebagai konstanta Avogadro. Itu baru 18 mililiter air, bayangkan jika kita meneguk segelas air atau mandi atau bahkan mengisi kolam renang, berapa banyak jumlah molekul air yang telah kita gunakan atau bahkan kita buang !!
Molekul Air yang cantik dan Istimewa
 Jika kita melihat bentuk molekul air, maka semakin terbukalah rahasia mengapa zat ini demikian istimewa. Sesungguhnya jika gas oksigen dan gas hidrogen bertemu untuk membentuk molekul air, reaksi yang terjadi sangatlah berbahaya karena bisa timbul panas yang tinggi bahkan ledakan karena oksigen adalah gas yang dibutuhkan untuk pembakaran dan hidrogen adalah gas yang mudah terbakar. Tapi untunglah Tuhan telah menyediakan air semenjak penciptaan sehingga kita tidak perlu membuat air dengan ledakan. Kurang lebih dibebaskan energi berupa panas sebesar 242 kilo Joule untuk membuat air sebanyak 18 gram dari 22,4 liter atau 2 gram gas hidrogen dan .11,2 liter atau 16 gram gas oksigen pada suhu 0 derajat Celcius dan tekanan satu atmosfer. Mari kita lihat bentuk molekul air yang berhasil diamati dengan berbagai percobaan dan perhitungan yang rumit.
Jika kita melihat bentuk molekul air, maka semakin terbukalah rahasia mengapa zat ini demikian istimewa. Sesungguhnya jika gas oksigen dan gas hidrogen bertemu untuk membentuk molekul air, reaksi yang terjadi sangatlah berbahaya karena bisa timbul panas yang tinggi bahkan ledakan karena oksigen adalah gas yang dibutuhkan untuk pembakaran dan hidrogen adalah gas yang mudah terbakar. Tapi untunglah Tuhan telah menyediakan air semenjak penciptaan sehingga kita tidak perlu membuat air dengan ledakan. Kurang lebih dibebaskan energi berupa panas sebesar 242 kilo Joule untuk membuat air sebanyak 18 gram dari 22,4 liter atau 2 gram gas hidrogen dan .11,2 liter atau 16 gram gas oksigen pada suhu 0 derajat Celcius dan tekanan satu atmosfer. Mari kita lihat bentuk molekul air yang berhasil diamati dengan berbagai percobaan dan perhitungan yang rumit.Bentuk molekul air tersebut dan terutama sifat elektroniknya menjadikan air memiliki sifat fisika dan kimia yang fantastis. Apakah sifat elektronik itu ? Dalam pemahaman kimia dan fisika, semua sifat-sifat atom dan molekul ditentukan oleh perangai dan keadaan elektron yang mengelilingi inti atom. Ternyata alam mengajarkan kita lebih banyak lagi tentang berbagi dan bekerja sama. Ikatan yang terjadi antara dua atom hidrogen dan satu atom oksigen menjadi satu molekul air disebut ikatan kovalen. Yaitu ikatan antar atom yang terjadi karena setiap atom menyumbangkan elektron yang dimiliki untuk saling berpasangan dan digunakan bersama membentuk satu ikatan. Namun, karena oksigen memiliki kelebihan pasangan elektron, maka elektron yang tidak membentuk ikatan tersebut dikatakan sebagai “pasangan elektron bebas“. Adanya elektron bebas yang bersifat sangat negatif menjauhkan kedudukannya dari dua atom hidrogen sehingga ikatan H2O membengkok sebesar 107.5 derajat. Sedangkan keadaan alamiah atom oksigen yang bersifat negatif dan atom hidrogen yang bersifat positif menimbulkan pengkutuban atau perbedaan muatan. Kedua keadaan itulah yang menjadikan molekul air bersifat polar, artinya molekul air memiliki perbedaan muatan yakni negatif pada sisi pasangan elektron bebas dan positif pada sisi atom hidrogen. Kepolaran air bisa berarti segalanya dan amatlah besar faedahnya. Kepolaranlah yang menjadikan air dapat menghantarkan arus listrik. Berkat sifat air yang polar, dia bisa melarutkan berbagai macam zat lain, misalnya darah, protein, vitamin, garam dan lain-lain. Kenyataannya, air merupakan pelarut universal yang paling ramah terhadap lingkungan. Demikian sebaliknya, air terpisah dari minyak dan lemak karena adanya perbedaan kepolaran. Coba bayangkan jika air dan minyak dapat bercampur, betapa susahnya membersihkan tumpahan minyak di laut lepas !!. Walaupun demikian, sering kali sifat air sebagai pelarut universal malah merugikan dirinya sendiri karena dia mudah sekali tercemari oleh beraneka ragam materi kimia maupun biologi sehingga sulit untuk membersihkannya lagi, apalagi ditambah dengan ketidakkepedulian kita untuk menjaga kemurniannya.
Adanya perbedaan muatan menjadikan ikatan antar molekul air sendiri cukup kuat sehingga pada suhu ruangan dia berbentuk cair, dibandingkan dengan bensin yang segera menguap. Aksi tarik menarik antara atom hidrogen di satu molekul air dengan pasangan elektron bebas pada molekul air yang lain disebut ikatan hidrogen dan oleh sebab itu diperlukan suhu 100o Celcius untuk mengubah keadaan cair menjadi uap. Air dikatakan memiliki nilai kalor spesifik yang tinggi, artinya diperlukan energi yang cukup besar untuk menjadikannya mendidih sebaliknya air dapat melepaskan panas perlahan-lahan ke lingkungan. Berkat sifat tersebut iklim di bumi tetap stabil demikian juga tubuh kita memiliki suhu yang konstan karena kurang lebih 70% permukaan bumi dan 60% tubuh mahluk hidup terdiri dari air.

Diposting oleh lnurlaily di 20.32 0 komentar
indahnya warna warni kembang api

Ketika Anda melemparkan sebuah atom ke dalam sebuah nyala api, atom itu dapat mengambil sebagian energi api dengan membuat elektron-elektronnya bergerak lebih cepat. Elektron-elektron “beringas” ini sebetulnya ingin kembali ke tingkat energi alami yang lebih santai (dalam bahasa ilmiah disebut ground state). Cara termudah bagi mereka untuk melakukannya adalah melepaskan energi lebihan mereka dalam bentuk semburan cahaya. Jika cukup banyak atom dalam sebuah nyala api secara serentak mengambil energi panas dan melemparkannya kembali dalam bentuk cahaya, kita dapat menyaksikan sebagai cahaya yang sangat terang.
Berikut ini beberapa jenis atom (dalam bentuk senyawa kimia masing-masing) yang di gunakan untuk membuat warna-warna dalam kembang api, merah didapat dari stronsium (paling sering dipakai) untuk membuat cahaya berwarna crimson (merah tua keunguan), kalsium untuk membuat warna merah kekuningan, lithium untuk membuat warna kuning hijau terang. Hijau didapat dari barium (paling sering dipakai) untuk membuat warna hijau kekuningan, tembaga untuk membuat warna hijau zamrud, telurium untuk membuat warna hijau rumput, thalium untuk membuat warna hijau kebiruan, seng untuk membuat hijau keputihan. Biru didapat dari tembaga (paling sering dipakai) untuk membuat warna azure (biru langit cerah), arsenikum untuk membuat warna biru muda, timbal untuk membuat warna biru muda, selium juga digunakan untuk membuat warna biru muda. Ungu didapat dari cesium untuk membuat warna ungu kebiruan, kalium untuk membuat warna ungu kemerahan, dan rubidium untuk membuat warna ungu.
Coba deh, Jika kalian menjumpai kesempatan membuat atau mengikuti beberapa acara api unggun, baik di gunung maupun di pantai, taburkan sedikit garam meja atau bubuk natrium bikarbonat (soda kue) ke atasnya maka Anda akan menyaksikan nyala kuning cemerlang yang telah dihasilkan oleh unsur natrium. Jika Anda memiliki bahan penggati garam, coba taburkan bahan itu (biasanya kalium klorida), maka Anda akan mendapatkan nyala khas kalium yang ungu kemerahan. Jika Anda membawa lithium untuk pengobatan manic depressive (semacam gangguan mental), hiburlah diri Anda dengan membuat nyala berwarna paling indah dalam hidup Anda.
sumber : www.chemistry.uii.ac.id
Diposting oleh lnurlaily di 20.30 0 komentar
Ahli Kimia Membuat Katalis Palladium untuk Sel Bahan Bakar Lebih Efisien.
Peralatan-peralatan kecil pun membutuhkan tenaga dan banyak tenaga listrik bersumber dari sel bahan bakar (Fuel cell). Sebagaimana peralatan tersebut menjadi semakin kecil permintaan yang sangat mendesak dibutuhkan saat ini adalah mencari cara yang lebih efisien untuk member tenaga untuk peralatan tersebut.
Beberapa tahun yang lalu, para ahli telah menemukan logam Palladium (Pd), yang merupakan kandidat kuat untuk menyediakan kenaikan tenaga listrik awal (initial boost) yang membantu menyalakan sel bahan bakar. Palladium jauh lebih murah daripada katalis se bahan bakar populer lainnya, Platinum, dan lebih melimpah.
Para peneliti berusaha mendapatkan pemecahan dengan membuat nanopartikel Palladium dengan area permukaan aktif yang cukup untuk membuat katalis lebih efisien dalam sel bahan bakar sewaktu mencegah partikel dari penggumpalan bersama-sama selama berlangsungnya proses kimia yang menkonversi bahan bakar menjadi listrik. Dua ahli kimia Universitas Brown telah menemukan cara untuk menghadapi tantangan ini.

A platinum alternative: Brown researchers have found a way to create a larger active surface area with palladium nanoparticles to catalyze energy-producing reactions in a fuel cell. (Credit: Image courtesy of Brown University)
Para ahli melaporkan dalam edisi online “Journal of The American Chemical Society” bahwa mereka telah membuat nanopartikel Palladium dengan luas permukaan 40% lebih besar daripada partikelPalladium yang umumnya tersedia. Katalis Brown juga empat kali tetap utuh daripada katalis yang digunakan sekarang ini. “Pendekatan baru”, kata Vismadeb Mazumder, Mahasiswa S2 yang bergabung dengan professor Kimia , Shouheng Sun pada papernya. “Ini dua kali lebih aktif yang berarti bahwa Anda membutuhkan setengah energy untuk mengakatalisis. Dan ini empat (4) kali lebih satbil”.
Mazumder dan Sun membuat nanopartikel Palladium berukuran 4,5 nm. Mereka melekatkan nanopartikel tersebu ke platform karbon pada ujung anoda dari sel bahan bakar asam format langsung (direct formic acid fuell cell). Peneliti melakukan hal yang baru yaitu mereka menggunakan / memanfaatkan ikatan lemah ligan-ligan amino untuk menjaga nanopartikel Palladium memisah dan tetap berada pada ukuran yang sama seperti ketika Palladium tersebut dilekatkan pada platform karbon. Dengan tetap menjaga partikel-partikel tersebut memisah dan berukuran seragam, partikel-partikel Palladium tersebut meningkatkan ketersediaan area permukaan pada platform dan memperbesar efisiensi sel bahan bakar (Fuel cell).
“Ini bekerja lebih baik”, kata Sun. Ada hal yang juga special dari ligan-ligan tersebut adalah “dapat dicuci” dari platform karbon tanpa merusak integritas pemisahan nanopartikel palladium. Hal ini merupakan langkah penting karena usaha sebelumnya untuk memindahkan atau menghilangkan ikatan bahan-bahan yang menyebabkan partikel-partikel kehilangan ukuran kaku mereka dan membentuk gumpalan secara bersama-sama, yang melekat selam reaksi berlangsung.
Tim Brown mengatakan dalam eksperimen yang menghabiskan waktu 12 jam , katalis Brown kehilangan 16% area permukaan dibandingkan dengan 64% kehilangan areapermukaan pada katalis komersial lainnya. “Kami mengatur keadaan pelemahan dari katalis kami dengan menggunakan pendekatan kami”, kata Mazumder, yang bekerja pada tahun ke dua di Laboratorium Sun. “Kami membuat nanopartikel Palladium kualitas tinggi, meletakkannya pada penopang atau penahan secara efisien, kemudian memindahkan dari stabilisator secara efisien tanpa mengubah kualitas katalis.”
Ahli kimia Universitas Brown sekarang mulai memandang pada katalis berbasis Palladium dengan memperbesar aktivitas dan stabilitas untuk aplikasi sel bahan bakar di masa yang akan datang. “Kami ingin membuatnya lebih murah dengan aktivitas yang sama” kata Mazumder.
Penelitian ini didanai oleh Division of Materials Research of The National Science Foundation dan A Brown Seed Fund.
sumber: www.ikahimki.chem.itb.ac.id
Diposting oleh lnurlaily di 18.58 1 komentar
Kamis, 17 Desember 2009
Memutuskan Ikatan Nitrogen-Nitrogen Lebih Efesien Tanpa Amonia
Untuk memecahkan beberapa ikatan kimia, ilmuwan telah memotong dua kandungan yang paling sulit dalam kimia di laboratorium seperti dalam mimpi memisahkan bayi kembar siam dengan satu otak dan semua hidup normal. Menghasilkan reaksi kimia dan dapat memberikan jalan lebih singkat untuk membuat berbagai obat-obatan atau senyawa penting secara biologis lainnya. Dalam esksperimen terbaru, kompleks logam dan karbon monoksida bersatu untuk membelah tiga ikatan yang menghubungkan dua atom nitrogen, salah satu ikatan alami terkuat dalam dunia kimia. Menghilangkan nitrogen yang terikat selalu menjadi tugas menakutkan. Bahkan ketika selesai tidak selalu menghasilkan produk yang bermanfaat.
Dalam esksperimen terbaru, kompleks logam dan karbon monoksida bersatu untuk membelah tiga ikatan yang menghubungkan dua atom nitrogen, salah satu ikatan alami terkuat dalam dunia kimia. Menghilangkan nitrogen yang terikat selalu menjadi tugas menakutkan. Bahkan ketika selesai tidak selalu menghasilkan produk yang bermanfaat.
Para peneliti melaporkan pada 3 Desember 13 di jurnal Nature Chemistry, reaksi baru menghasilkan senyawa dengan ikatan karbon-nitrogen dan hasil dalam suhu dan tekanan halus. Reaksi kimia ini menghindari jalan memutar yang mahal karena harus membuat amonia (nitrogen dan hidrogen). "Ini merupakan kontribusi penting. Kita dapat menambahkannya ke kotak peralatan kimia," kata Christopher Cummins dari laboratorium MIT.
Sekitar 78 persen dari atmosfer bumi adalah nitrogen, tetapi pemanfaatan tidak mudah. Nitrogen atmosfer hidup seperti kembar yang tak terpisahkan, dalam bentuk N2, sangat terkait dengan ikatan rangkap tiga dan relatif inert. Dinitrogen ini akan bereaksi dengan oksigen dan hujan ke bumi di mana berbagai mikroba "memperbaiki", memisahkan si kembar, membuat mereka tersedia untuk ikatan dengan molekul lain, seperti karbon.
Untuk mendapatkan ikatan karbon-nitrogen di laboratorium, Paul Chirik kimiawan Cornell University menembak ikatan N2 dengan logam dan karbon monoksida. Para ilmuwan memulai dengan kompleks logam hafnium dan dinitrogen dalam larutan dan kemudian ditambahkan gas karbon monoksida. Elektron dari hafnium dan karbon "merobek ikatan tiga". Sebagai bagian dari reaksi, karbon dari karbon monoksida kemudian ikatan atom nitrogen menciptakan ikatan karbon-nitrogen yang berguna.
Membuat senyawa, seperti nilon yang memerlukan ikatan karbon-nitrogen saat ini membutuhkan pembuatan amonia di sepanjang proses. Metode baru mungkin menawarkan alternatif. "Ini seolah-olah anda terbang dari New York ke Miami dan anda harus transit di Chicago. Namun, kami mencoba untuk terbang secara langsung," kata Chirik.
Meskipun hasil kimia oxamide dalam catatan Chirik tidak dilakukan dalam jumlah yang cukup besar untuk segera aplikatif. Dan reaksi sementara membebaskan nitrogen, namun penggunaan amonia manjadi tidak efesien, Haber-Bosch process sudah melaksanakan pekerjaan dengan baik dan dapat digunakan secara luas. Tetapi dalam banyak contoh, mencari tahu cara untuk melewatkan suhu Haber-Bosch, kebutuhan tekanan, dan permintaan energi yang terkait akan menjadi plus. Reaksi-reaksi ini dapat memberikan kimia baru untuk membuat obat-obatan dan senyawa penting secara biologis lainnya. "Diharapan adalah rekayasa dalam proses industri," kata Cummins.
Diposting oleh lnurlaily di 18.12 0 komentar
Mercuri dalam Tambalan Gigi Semakin Kehilangan Daya Racun
Sebuah studi baru pada kimia pewarna perak permukaan, penambal gigi (fillings amalgam) berbasis mercury menunjukkan bahwa bentuk-bentuk permukaan mercury mungkin kurang beracun dari pemikiran sebelumnya. Studi ini dipublikasikan di jurnal ACS Chemical Research in Toxicology. George Graham dan kolega mencatat bahwa merkuri berbasis isi, juga disebut peleburan, telah digunakan oleh dokter gigi untuk memperbaiki gigi selama lebih dari satu abad. Pada dekade belakangan ini penggunaannya telah menjadi kontroversial karena kekhawatiran tentang paparan merkuri yang berbahaya. Namun, merkuri dapat berpotensi dalam beberapa bentuk kimia yang berbeda, masing-masing dengan toksisitas yang berbeda. Sebelum laporan ini, hanya sedikit yang diketahui tentang bagaimana bentuk kimia merkuri dalam amalgam gigi dapat berubah seiring waktu.
George Graham dan kolega mencatat bahwa merkuri berbasis isi, juga disebut peleburan, telah digunakan oleh dokter gigi untuk memperbaiki gigi selama lebih dari satu abad. Pada dekade belakangan ini penggunaannya telah menjadi kontroversial karena kekhawatiran tentang paparan merkuri yang berbahaya. Namun, merkuri dapat berpotensi dalam beberapa bentuk kimia yang berbeda, masing-masing dengan toksisitas yang berbeda. Sebelum laporan ini, hanya sedikit yang diketahui tentang bagaimana bentuk kimia merkuri dalam amalgam gigi dapat berubah seiring waktu.
Dengan menggunakan teknik khusus sinar-X, para ilmuwan menganalisis permukaan tambalan logam baru disiapkan dan membandingkannya dengan usia permukaan tambalan (sekitar 20 tahun) dari sebuah klinik gigi. Tambalan baru mengandung merkuri metalik yang dapat beracun. Namun usia tambalan yang sudah lama biasanya berisi suatu bentuk merkuri yang disebut beta-mercuric sulfide atau metacinnabar yang tidak mungkin beracun dalam tubuh.
Para ilmuwan menemukan bahwa permukaan tambalan logam tampaknya kehilangan hingga 95 persen merkuri mereka dari waktu ke waktu. Kehilangan potensi beracun merkuri dari amalgam mungkin disebabkan oleh proses penguapan, paparan terhadap beberapa jenis produk-produk kesehatan gigi, paparan terhadap makanan tertentu, atau faktor lainnya.
sumber : www.kesimpulan.com
Diposting oleh lnurlaily di 18.08 0 komentar
Atmosfir Bumi Berasal dari Ruang Angkasa?
Analisis fosil gas mulia memberikan petunjuk bahwa udara tidak muncul dari dalam planet. Isotop gas krypton dan xenon menyarankan bahwa sebagian besar atmosfir Bumi berasal dari luar angkasa, bukan dari Bumi (inner space). Krypton (orang Indonesia sering menyebut kripton) dan xenon muncul di atmosfer Bumi dan di alam semesta secara keseluruhan hanya dalam jumlah jejak.
 Greg Holland, geokimiawan isotop dari University of Manchester di Inggris mengatakan bahwa analisis rinci gas memberikan petunjuk tentang komponen atmosfer, dari mana berasal. Analisis yang dilaporkan pada 11 Desember di jurnal Science menunjukkan bahwa gas tersebut dan juga banyak yang lain (yang kini menyelimuti planet Bumi) terbentuk melalui komet atau tersapu dari awan gas terdekat selama tahap akhir pembentukan Bumi.
Greg Holland, geokimiawan isotop dari University of Manchester di Inggris mengatakan bahwa analisis rinci gas memberikan petunjuk tentang komponen atmosfer, dari mana berasal. Analisis yang dilaporkan pada 11 Desember di jurnal Science menunjukkan bahwa gas tersebut dan juga banyak yang lain (yang kini menyelimuti planet Bumi) terbentuk melalui komet atau tersapu dari awan gas terdekat selama tahap akhir pembentukan Bumi.
Beberapa ilmuwan telah mengusulkan bahwa gas di atmosfer Bumi berasal dari dalam planet ini. Menurut argumen mereka, suasana atmosfir juga merembes keluar dari Bumi sebagai planet secara bertahap didinginkan atau diusir dari kerak perut ketika sejumlah besar asteroid memukul planet dan permukaannya meleleh sekitar 3,9 milyar tahun yang lalu. Tapi bukti isotopik baru yang dikumpulkan oleh Holland dan koleganya menunjukkan bahwa skenario tersebut kemungkinan tidak benar.
Para peneliti menganalisis sampel gas yang diambil dari reservoir alami karbon dioksida yang terletak beberapa ratus meter di bawah tanah bagian timur laut New Mexico. Holland menjelaskan, krypton dan xenon yang berasal jauh di dalam Bumi (gas-gas yang mungkin terakumulasi ketika planet ini menyatu miliaran tahun lalu) bercampur dengan sejumlah kecil dari atmosferik krypton dan xenon dibawa turun oleh curah hujan dan air tanah.
Rasio isotop krypton dan xenon hadir dalam reservoir geologi tidak sesuai dengan rasio terlihat dalam suasana hari ini. Secara khusus, isotop yang lebih berat dari masing-masing gas muncul dalam proporsi yang lebih besar pada sampel di bawah tanah dibandingkan yang dilakukan di atmosfer. Jadi tidak mungkin bahwa sejumlah besar gas-gas atmosferik ini berasal dari dalam bumi.
Analisis juga menunjukkan bahwa jika sampel gas geologi tidak dinodai oleh atmosferik krypton dan xenon, rasio isotop gas yang diukur oleh peneliti akan cocok dengan rasio yang dilihat pada meteorit. Holland menyatakan bahwa tanda lain baik planet atau meteorit adalah sumber cahaya isotopically xenon dan krypton pada atmosfer saat ini. Sebaliknya, Holland dan rekan-rekannya mengusulkan bahwa krypton dan xenon yang kini hadir di udara dan banyak lainnya dari komponen atmosfer mungkin sisa-sisa dari awan gas terbuai saat membentuk Bumi. Atau, gas mungkin telah dikirimkan ke Bumi oleh komet, di mana proporsi isotop cahaya untuk xenon dan krypton relatif lebih tinggi.
"Ini adalah analisis yang menarik dan kontribusi yang sangat penting untuk mempelajari bagaimana lingkungan berevolusi," kata Robert Pepin, astrofisikawan dari University of Minnesota di Minneapolis. Namun hasilnya tidak jelas. Krypton dan xenon dalam lingkungan pada hari ini mungkin menjadi cahaya campuran gas isotopically yang disampaikan oleh komet dan versi yang lebih berat yang berasal dari dalam bumi.
Diposting oleh lnurlaily di 18.06 0 komentar
Daur Ulang Kantong Plastik HDPE dan LDPE
Limbah plastik dari tas "sekali pakai" dapat segera diubah menjadi carbon nanotubes. Kimiawan yang mengembangkan teknik ini bahkan menggunakan nanotube untuk membuat baterai lithium-ion. Disebut "upcycling", mengubah suatu produk limbah menjadi sesuatu yang lebih berharga. Mencari cara untuk upcycle limbah dapat mendorong lebih banyak daur ulang misalnya bakteri dapat mengubah sampah botol minuman plastik ke plastik yang justru lebih mahal. Teknik nanotube ini dikembangkan oleh Vilas Ganpat Pol dari Argonne National Laboratory di Illinois serta mengkonversi high density polyethylene (HDPE) dan low density polyethylene (LDPE) ke senilai multiwalled carbon nanotubes. Pol membuat nanotube dengan memasak 1 gram potongan HDPE atau LDPE pada 700°C selama 2 jam di hadapan sebuah katalis asetat kobalt (cobalt acetate catalyst), kemudian membiarkan campuran dingin secara bertahap. Di atas 600°C, ikatan kimia dalam plastik benar-benar terurai dan multiwalled carbon nanotubes tumbuh pada permukaan partikel katalis.
Teknik nanotube ini dikembangkan oleh Vilas Ganpat Pol dari Argonne National Laboratory di Illinois serta mengkonversi high density polyethylene (HDPE) dan low density polyethylene (LDPE) ke senilai multiwalled carbon nanotubes. Pol membuat nanotube dengan memasak 1 gram potongan HDPE atau LDPE pada 700°C selama 2 jam di hadapan sebuah katalis asetat kobalt (cobalt acetate catalyst), kemudian membiarkan campuran dingin secara bertahap. Di atas 600°C, ikatan kimia dalam plastik benar-benar terurai dan multiwalled carbon nanotubes tumbuh pada permukaan partikel katalis.
Banyak katalis yang dibutuhkan untuk mendapatkan hasil yang lebih baik (sekitar seperlima dari berat plastik setelah dikonversi) dan tidak bisa dengan mudah dapat dipulihkan kembali setelah itu. Tapi Pol mengatakan ini masih menjadi salah satu cara yang paling murah dan ramah lingkungan untuk menumbuhkan nanotube. "Metode lain biasanya memerlukan oksigen vakum untuk menghindari interaksi dengan katalis maupun sistem. Saya memakia reaksi baru yang tidak membutuhkan vakum, pembentukan oksida terhambat karena penggurangan atmosfir hidrokarbon terus-menerus pada 700°C," kata Pol.
Masing-masing potongan katalis menjadi terperangkap di dalam kepadatan nanotube yang baru tumbuh. Tapi Pol telah menunjukkan nanotube dapat digunakan sebagaimana mestinya tanpa pemrosesan lebih lanjut untuk bebas memotongnya. "Saya menyiapkan penggunaan cobalt nanotube sebagai bahan anoda bagi baterai lithium-ion dan kinerjanya luar biasa. Kapasitas spesifik carbon nanotubes buatan saya lebih tinggi dari nanotube komersial saat ini," kata Pol. Mungkin ada sedikit ketidaksempurnaan dalam struktur reguler dari nanotube, diciptakan oleh penguranggan atmosfir selama fabrikasi.
Kotoran cobalt juga membuat nanotube cocok untuk digunakan pada baterai lithium-udara, karena cobalt dikonversi menjadi cobalt oxides yang bertindak sebagai katalis untuk membantu reaksi ion pada baterai yang memungkinkan aliran arus. "Yang cobalt bukanlah sebuah kotoran, tapi adalah aset," kata Pol yang telah mendapat paten untuk penggunaan nanotube yang mengandung cobalt baik lithium ion maupun lithium air batteries.
Geoffrey Mitchell dari University of Reading di Inggris adalah pakar plastik daur ulang mengatakan bahwa teknik baru oleh Pol adalah "menarik bagian dari teka-teki" daur ulang sampah plastik untuk membuat nilai lebih tinggi bagi bahan elektronik. Tapi penggunaan cobalt relatif mahal sebagai non-recoverable catalyst mungkin bermasalah jika sistem selalu harus ditingkatkan.
Pol setuju, tetapi jenis baterai buatannya menggunakan nanotube yang sudah siap didaur ulang untuk cobalt mereka, sehingga logam pada akhirnya akan dapat dikembalikan. Membiarkan katalis dari proses sekaligus menghasilkan produk karbon lain memiliki nilai potensial, meskipun bola karbon bola antara 2 hingga 10 mikrometer yang dapat digunakan dalam tinta printer. (Journal of Environmental Monitoring, DOI:10.1039/b914648b)
Diposting oleh lnurlaily di 17.58 0 komentar
Karakteristik Warna Emas dan Tembaga
Logam biasanya berwarna abu-abu atau perak tergantung pada “electron sea”nya yang mampu menyerap dan memancarkan kembali foton di sekelilingnya, namun tembaga dan emas merupakan unsur logam yang mempunyai warna karakteristik dan alami.
Warna Khas Emas
 Emas adalah unsur dalam tabel periodik yang mempunyai simbol Au(Aurum) dan mempunyai nomor atom 79. Emas merupakan salah satu unsur logam transisi yang dikenal dengan logam mulia. Emas juga termasuk unsur logam yang mempunyai warna. Namun Warna emas tidak sama dengan warna logam umumnya, logam emas berwarna kuning mengkilat dan tidak mudah pudar. Dari kekhasan warna yang ditimbulkan logam ini maka terdapat warna yang disebut kuning keemasan. Warna ini terdiri dari 87,5% kuning dan 12,5% merah. Koloid emas mempunyai warna tajam yaitu ungu. Warna emas disebabkan oleh frekuensi plasmon emas yang berlokasi di julat penglihatan. Hal ini menyebabkan warna merah dan kuning direfleksikan, sedangkan warna biru akan diserap
Emas adalah unsur dalam tabel periodik yang mempunyai simbol Au(Aurum) dan mempunyai nomor atom 79. Emas merupakan salah satu unsur logam transisi yang dikenal dengan logam mulia. Emas juga termasuk unsur logam yang mempunyai warna. Namun Warna emas tidak sama dengan warna logam umumnya, logam emas berwarna kuning mengkilat dan tidak mudah pudar. Dari kekhasan warna yang ditimbulkan logam ini maka terdapat warna yang disebut kuning keemasan. Warna ini terdiri dari 87,5% kuning dan 12,5% merah. Koloid emas mempunyai warna tajam yaitu ungu. Warna emas disebabkan oleh frekuensi plasmon emas yang berlokasi di julat penglihatan. Hal ini menyebabkan warna merah dan kuning direfleksikan, sedangkan warna biru akan diserap
Warna Khas Tembaga

Tembaga merupakan salah satu unsur logam transisi yang berwaarna coklat kemerahan karena lapisan tipis yang pudar secara berangsur-angsur yang terbentuk pada permukaan ketika gas di udara bereaksi dengan tembaga itu. Tetapi, tembaga murni mempunyai warna merah jambu. Tembaga mempunyai karakteristik warna karena struktur ikatannya. Pada bentuk cair, permukaaan tembaga murni yang tidak terkena cahaya kelihatan seperti kehijauan, karakter yang serupa dengan emas. Ketika tembaga cair diterangi dengan cahaya, maka akan berwarna pink berkilau. Ketika tembaga dibakar dengan oksigen akan timbul oksida hitam.
Diposting oleh lnurlaily di 17.49 0 komentar
Mengapa air laut mengandung garam? Seberapa besar kandungan garam di Laut?
![]() Garam di laut sangat berbeda dengan garam di dapur anda. Garam di laut sebenarnya merupakan larutan yang sangat kompleks dan mengandung lebih dari lima puluh garam mineral alami. Dalam air laut, kandungan sodium klorida (garam dapur) yang paling melimpah, sedangkan mineral lainnya dalam konsentrasi rendah antara lain garam kalsium (kalsium karbonat, magnesium sulfat, dan magnesium bromida).
Garam di laut sangat berbeda dengan garam di dapur anda. Garam di laut sebenarnya merupakan larutan yang sangat kompleks dan mengandung lebih dari lima puluh garam mineral alami. Dalam air laut, kandungan sodium klorida (garam dapur) yang paling melimpah, sedangkan mineral lainnya dalam konsentrasi rendah antara lain garam kalsium (kalsium karbonat, magnesium sulfat, dan magnesium bromida).
Tambahan lagi ada sedimen terlarut dan batu-batuan dari dasar laut, materi dari sisa-sisa mahluk hidup yang mati dan air. Garam terlarut dibawa ke laut dari sungai dan aliran air, hampir 4 miliar ton pertahun.
Para ilmuwan berpikir bahwa total jumlah garam di semua laut mungkin hampir 50 juta milyar ton. Konsentrasi garam pada kebanyakan air laut adalah tiga puluh lima per mil, yang berarti bahwa 3.5% berat air laut berasal dari garam terlarut. Kebanyakan garam dapur berasal dari pertambangan bukan dari garam laut. Kadangkala, yodium juga ditambahkan ke dalam garam dapur untuk membesarnya kelenjar tiroid yang disebut goiter. Sejak pabrik menambahkan yodium ke dalam garam dapur, penyakit goiter jarang terlihat di negara industri dan negara utama, tetapi masih banyak ditemukan di negara berkembang.
Kandungan Garam di Laut
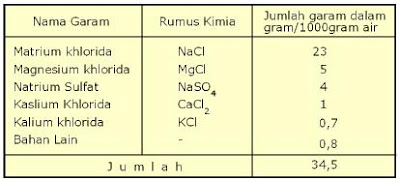
Menurut ilmu kelautan garam-garaman utama yang terdapat dalam air laut adalah klorida (55%), natrium (31%), sulfat (8%), magnesium (4%), kalsium (1%), potasium (1%) dan sisanya (kurang dari 1%) teridiri dari bikarbonat, bromida, asam borak, strontium dan florida. Tiga sumber utama garam-garaman di laut adalah pelapukan batuan di darat, gas-gas vulkanik dan sirkulasi lubang-lubang hidrotermal (hydrothermal vents) di laut dalam.
| |
Kadar Garam Lautan
Kadar garam atau salinitas ialah banyaknya garam-garaman (dalam gram) yang terdapat dalam 1 Kg (1000 gr) air laut, yang dinyatakan dengan ‰ atau perseribu. Salinitas umumnya stabil, walaupun di beberapa tempat terjadi fluktuasi.
Tinggi rendahnya kadar garam (salinitas) sangat tergantung kepada faktor-faktor berikut : | ||||||||
|
Sumber : http://www.e-dukasi.net/mol/mo_full.php?moid=99&fname=geox0813.htm
Sumber : http://tanyasayaapasaja.blogspot.com/
Sumber:http://ilmukelautan.com/oseanografi/oseanografi-kimia
Diposting oleh lnurlaily di 17.20 0 komentar
Selasa, 08 Desember 2009
Menghitung Ruang Rongga
1. Primitif Cube ( Kubus Sederhana )
Jika suatu kubus sederhana tersusun oleh atom-atom dengan jari-jari r, dan panjang sisi kubus adalah a, maka % volume ruang kosong/ rongga dalam kubus:
- Volume rongga = volume kubus – 8 x 1/8 volume atom
= a x a x a – 4/3 r3
= 2r x 2r x 2r – 4/3 r3
= 8r3 -4,187r3
=3.813 r3
· Jadi % rongga Kubus sederhana = 3,813 r3 / 8r3 X 100%
= 47,67 %
2. Body Center Cube ( Kubus Pusat Badan )
Pada BCC diagonal ruang merupakan jumlah dari 4 buah jari-jari atom =4r . karena tiap bagian atom saling bersentuhan,,
- Diagonal persegi = √a2 + a2
= a√2
- Maka, Panjang diagonal ruang kubus= a √3 =1,732 a
1,732 a = 4r
a = 4r /1,732
a =2,31r
- Volume rongga = volume kubus- 2 volume atom
= a x a x a – 2 x 4/3 π r3
= 2,31r x 2,31r x 2,31r- 8/3 π r3
= 12,31 r3- 8,37 r3
=3,94 r3
- Jadi % rongga kubus pusat badan = 3,94 r3 / 12,31 r3 X 100%
= 32 %
3. Face Center Cube ( Kubus Pusat Muka )

- Jumlah atom yang mempunyai 1 satuan sel kubus pusat muka (fcc) adalah 4 atom, yaitu:
Jumlah atom disetiap sudut + jumlah atom di permukaan = (8 x 1/8) + (6 x 1/2)
= 1+3
= 4 atomv
- Panjang diagonal sisi = √a2 + a2
= a√2
= 1,414 a
1,414 a = 4r
a = 4r / 1,414
a = 2,83 r
- Volume rongga = volume kubus- 4 volume atom
= a x ax a – 4 x 4/3 π r3
=2,83 r x 2,83 r x 2,83 r - 16/3x π r3
= 22,615 r3- 16,75 r3
=5,86 r3
- Jadi % rongga FCC = 5,86 r3 / 16,75 r3 X 100%
Diposting oleh lnurlaily di 20.39 0 komentar